Project 01
研究プロジェクト01タンパク質フォールディングと分子シャペロン
Protein folding and molecular chaperones
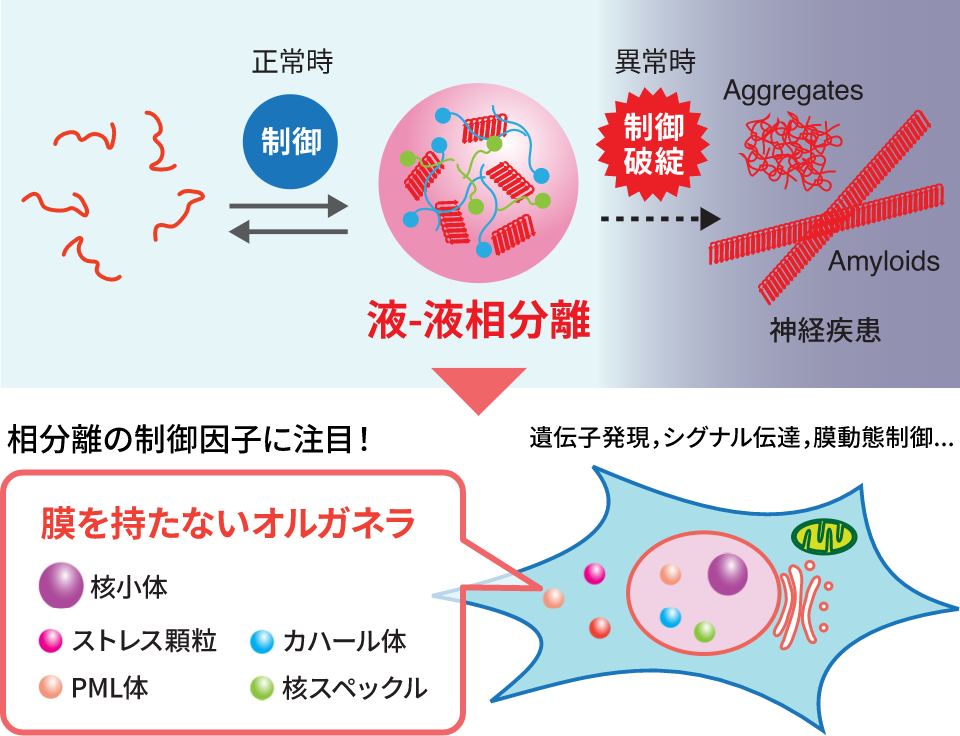
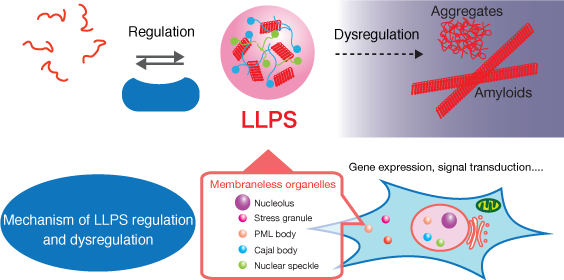
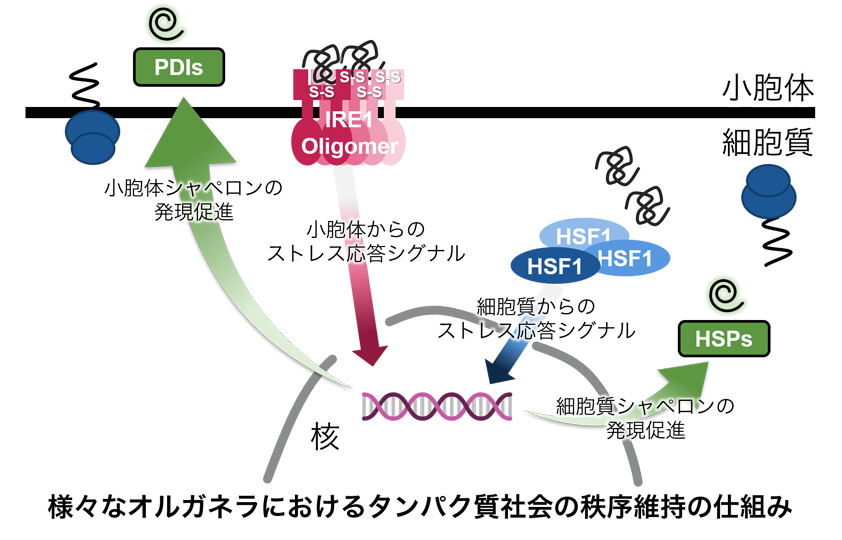
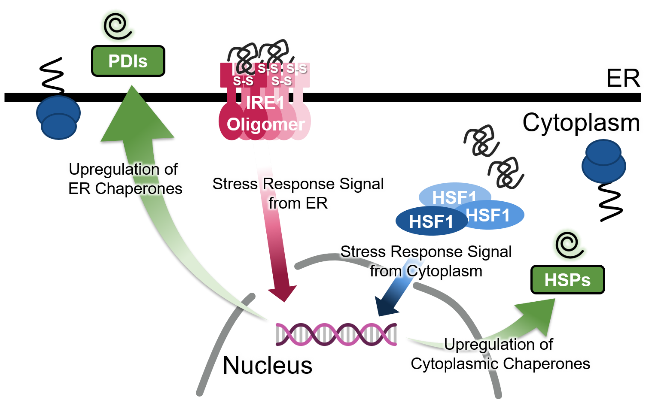
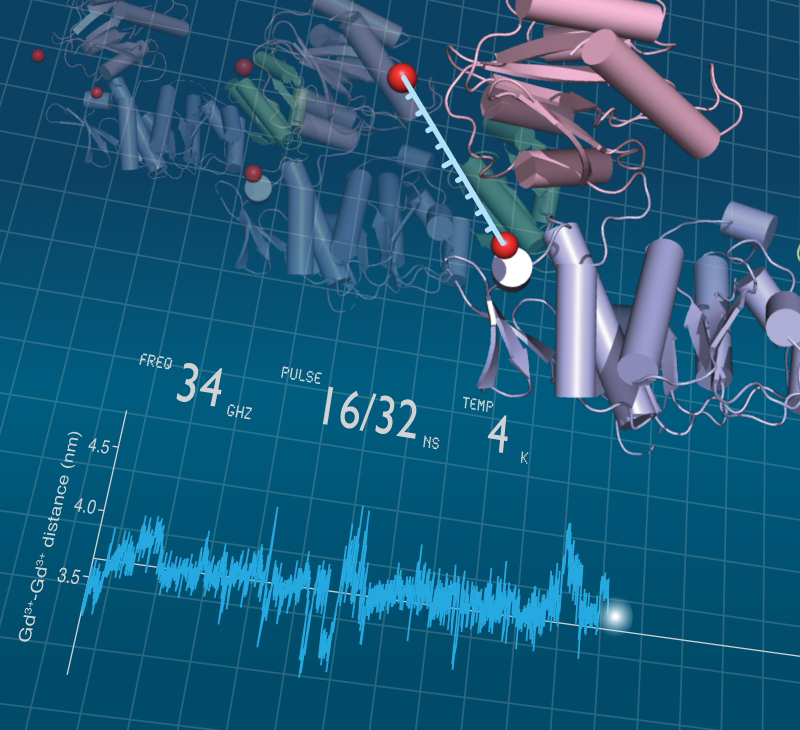
−タンパク質社会の医療システム−– Medical system of protein society –私たちが健康な生活を送るために病院や医療システムがあるように、細胞内のタンパク質が正しく機能するためには分子シャペロンが必須です。さらに、疾患ごとの専門医がいるように、シャペロンにもそれぞれの“専門”があり、複数のシャペロンがそれぞれ固有の機能を発揮することによって、新生タンパク質のフォールディング補助、失活した不良タンパク質の“治療”(再フォールディング)または分解などが行われます。翻訳されたタンパク質の大部分がシャペロンとの相互作用を介して成熟していき、シャペロン分子なしに細胞は生きていくことができません。 また、ガン細胞においてはシャペロンの発現量が異常に高まっていたり、反対にシャペロンの機能不全がアルツハイマー病、ALSなどの神経難病の要因となったりと、シャペロンは疾病との関連も深い生体分子の一つです。私たちは、このように多彩な機能を持つシャペロンに注目し、シャペロンがどうやって機能しているのか、そのメカニズムを分子レベルから解明することを目指した研究をしています。
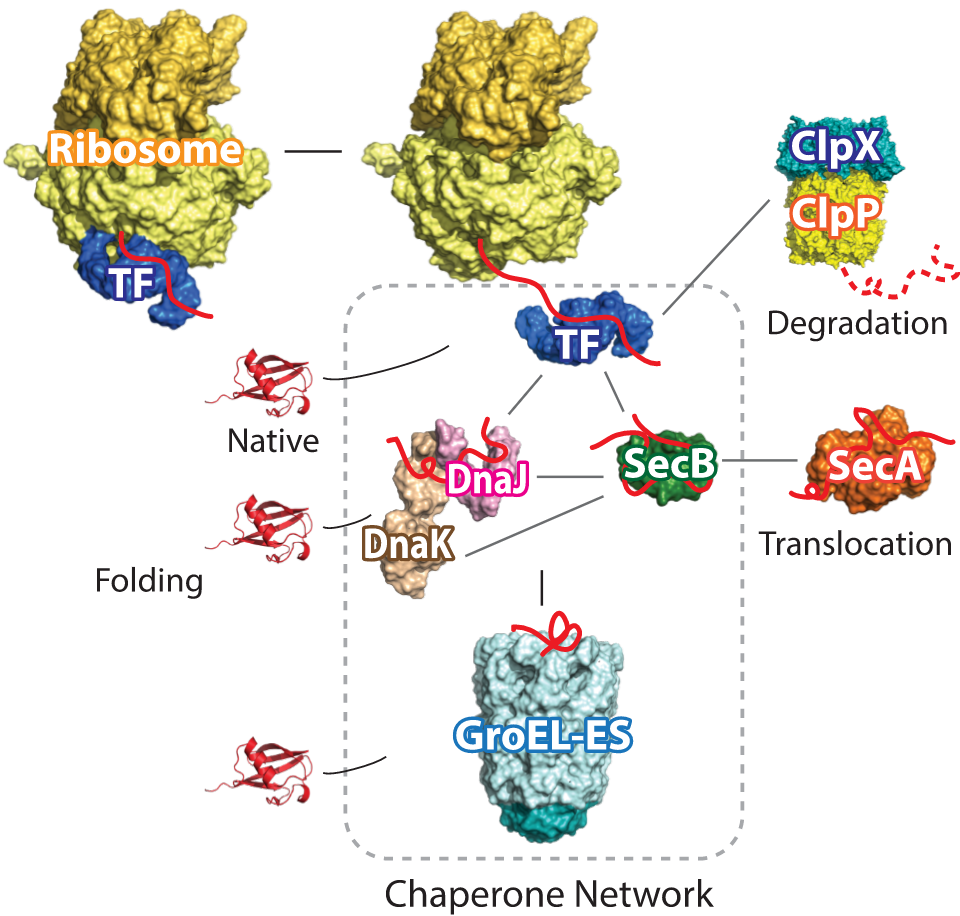
Just as hospitals and medical systems in our society, molecular chaperones are essential components for keeping the protein homeostasis in the cell, in which each chaperone exerts specific functions just like a medical specialist.The functions of chaperones include assistance in the folding of newly synthesized proteins and in repairing or removing misfolded proteins. Cells cannot survive without chaperone molecules, because the majority of translated proteins are matured through interactions with chaperones. In addition, chaperone expression is abnormally upregulated in cancer cells, and chaperone dysfunction is a cause of neurodegenerative diseases such as Alzheimer’s disease and ALS. Our research focuses on chaperones and aims to elucidate how chaperones function at the molecular level.